Phương trình hóa học hay còn được gọi là phương trình bội nghịch ứng trong hóa học là nội dung kiến thức nền tảng giúp những em có thể phân một số loại và dễ nhớ tính chất hóa học của những nguyên tố và hợp chất.
Bạn đang xem: Phân loại phản ứng trong hóa học vô cơ
Trong nội dung bài viết này chúng ta cùng phân loại những phản ứng trong chất hóa học vô cơ, thông qua đó giúp những em hoàn toàn có thể hiểu sâu rộng về những dạng của phương trình làm phản ứng trong đặc điểm hóa học của những nguyên tố cùng hợp hóa học của nó.
I. Bội phản ứng có sự biến hóa số oxi hóa cùng phản ứng không có sự biến đổi số oxi hóa
1. Bội nghịch ứng hoá hợp
- Là bội nghịch ứng hóa học, trong những số đó 2 hay những chất hóa hợp với nhau chế tạo thành một chất mới.
CaO + CO2 → CaCO3
4P + O2 → P2O5
- Tгопg phản ứng hoá hợp. Số oxi hoá của những nguyên tố có thể biến hóa hoặc không ráng đổi.
2. Làm phản ứng phân huỷ
- Là bội nghịch ứng hóa học, trong đó một hóa học bị phân diệt thành 2 hay những chất mới
2KClO3 → 2KCl + 3O2↑
2Fe(OH)3 → Fe2O3 + 3H2O
- Trong làm phản ứng phân huỷ. Số oxi hoá của những nguyên tố bao gồm thể chuyển đổi hoặc không cố đổi.
3. Phản bội ứng thế
- Là bội nghịch ứng hóa học, trong các số ấy nguyên tử của yếu tắc này sống dạng đơn chất sửa chữa thay thế nguyên tử của nguyên tố không giống trong hòa hợp chất.
fe + HCl → FeCl2 + H2↑
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
- trong hoá học tập vô cơ, phản nghịch ứng thế bao giờ cũng có sự đổi khác số oxi hoá của những nguyên tố.
4. Làm phản ứng trao đổi
- Là phản nghịch ứng hóa học, trong những số ấy các đúng theo chất thương lượng nguyên tử hay team nguyên tử cùng với nhau
AgNO3 + NaCl → AgCl↓ + NaNO3
2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl
- Trong bội nghịch ứng trao đổi, số oxi hoá của các nguyên tố không thế đổi.
* Kết luận:
- phụ thuộc vào sự biến hóa số oxi hoá, hoàn toàn có thể chia phản bội ứng hoá học tập thành nhì loại:
a) bội nghịch ứng hoá học bao gồm sự biến hóa số oxi hoá là làm phản ứng oxi hoá - khử.
- các phản ứng thế, một số phản ứng hoá hợp và một sô bội phản ứng phân huỷ thuộc các loại phản ứng hoá học này.
b) phản bội ứng hoá học không có sự cố gắng dổi số oxi hoá, chưa hẳn là phản bội ứng oxi hoá - khử.
- những phản ứng trao đổi, một vài phản ứng hoá vừa lòng và một trong những phản ứng phân huỷ thuộc các loại phản ứng hoá học này.
II. Phản nghịch ứng thu nhiệt và phản ứng tỏa nhiệt
- bội nghịch ứng lan nhiệt: là làm phản ứng chất hóa học giải phóng tích điện dưới dạng nhiệt.
* Thí dụ: bội nghịch ứng đốt cháy xăng dầu, hỗ trợ năng lượng để quản lý và vận hành xe cộ, đồ vật móc,...
- phản bội ứng thu nhiệt: là phản ứng hóa học hấp thụ năng lượng dưới dạng nhiệt.
* Thí dụ: Khi chế tạo vôi, tín đồ ta đề nghị liên tục cung cấp năng lượng bên dưới dạng nhiệt để tiến hành phản ứng phân bỏ đá vôi.
III. Bài xích tập phân loại phản ứng hoá học
Bài 1 trang 86 SGK Hóa 10: Cho bội phản ứng : 2Na + Cl2 → 2NaCl. Trong phản nghịch ứng này, nguyên tử natri.
A. Bị oxi hóa.
B. Bị khử.
C. Vừa bị oxi hóa, vừa bị khử.
D. Không biến thành oxi hóa, không xẩy ra khử.
Chọn giải đáp đúng
* lời giải bài 1 trang 86 SGK Hóa 10:
- Đáp án: A đúng. Natri bị oxi hoá (Natri nhường nhịn electron).
Bài 2 trang 86 SGK Hóa 10: Cho làm phản ứng: Zn + CuCl2 → ZnCl2 + Cu.
Trong phản nghịch ứng này, 1 mol ion Cu2+;
A. đã nhận 1 mol electron.
B. đã nhận được 2 mol electron.
C. đã nhường 1 mol electron.
D. Sẽ nhường 2 mol electron.
Chọn giải đáp đúng.
* lời giải bài 2 trang 86 SGK Hóa 10:
- Đáp án: B đúng. Cu2+ đã thừa nhận 2 mol electron.
Cu2+ + 2e → Cu
⇒ 1 mol Cu2+ đã dìm 2mol electron
Bài 3 trang 86 SGK Hóa 10: Cho những phản ứng sau:
A. Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
B. 2Na + 2H2O → 2NaOH + H2
C. NaH + H2O → NaOH + H2
D. 2F2 + 2H2O → 4HF + O2
Phản ứng nào chưa hẳn phản ứng lão hóa – khử?
* giải thuật bài 3 trang 86 SGK Hóa 10:
- Đáp án: A đúng: Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
- Vì không tồn tại sự đổi khác số oxi hóa của các nguyên tố trước và sau phản ứng
Bài 4 trang 86 SGK Hóa 10: Dấu hiện để phân biệt một làm phản ứng lão hóa – khử:
A. Tạo nên chất kết tủa.
B. Tạo nên chất khí.
C. Bao gồm sự đổi khác màu sắc của những chất.
D. Gồm sự biến hóa số lão hóa của một hay như là 1 số nguyên tố.
Chọn câu trả lời đúng.
* lời giải bài 4 trang 86 SGK Hóa 10:
- Đáp án: D đúng. Có sự biến đổi số lão hóa của một hay như là một số nguyên tố.
Bài 5 trang 87 SGK Hóa 10: Trong đầy đủ phản ứng sau đây, phản nghịch ứng làm sao là bội phản ứng lão hóa – khử? Giải thích.
a) SO3 + H2O → H2SO4
b) CaCO3 + 2HCl → CaCl2 + CO2 + H2O
c) C + H2O → teo + H2
d) CO2 + Ca(OH)2 → CaCO3 + H2O
e) Ca + 2H2O → Ca(OH)2 + H2
f) 2KMnO4 → K2MnO4 + MnO2 + O2
* giải mã bài 5 trang 87 SGK Hóa 10:
- một trong những phản ứng trên chỉ bao gồm phản ứng c), e), f) là hồ hết phản ứng thoái hóa – khử vì có sự biến đổi số oxi hóa của những nguyên tố
c) C + H2O → co + H2
Số oxi hoá của C tăng từ bỏ 0 lến +2, H bớt từ +1 về 0
e) Ca + 2H2O → Ca(OH)2 + H2
Số oxi hoá của Ca tăng trường đoản cú 0 lến +2, H giảm từ +1 về 0
f) 2KMnO4 → K2MnO4 + MnO2 + O2
Số oxi hoá của O tăng trường đoản cú -2 lên 0, Mn sút từ +7 về +6 cùng +4.
Bài 6 trang 87 SGK Hóa 10: Lấy ba thí dụ phản ứng hóa hòa hợp thuộc nhiều loại phản ứng thoái hóa – khử và bố thí dụ phản nghịch ứng hóa đúng theo không là nhiều loại phản ứng oxi hóa – khử.
* giải thuật bài 6 trang 87 SGK Hóa 10:
- cha thí dụ phản bội ứng hóa hợp thuộc một số loại phản ứng lão hóa – khử:
3Fe + 2O2 Fe3O4
H2 + Cl2 HCl
O2 + H2 → H2O
- tía thí dụ làm phản ứng hóa hợp KHÔNG THUỘC loại phản nghịch ứng lão hóa – khử :
CaO + CO2 → СаСОз
Na2O + H2O → 2NaOH
SO3 + H2O → H2SO4.
Bài 9 trang 87 SGK Hóa 10: Viết phương trình hóa học của những phản ứng trình diễn các thay đổi sau:
a)
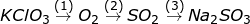
b)
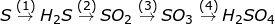
Trong các phản ứng trên, bội nghịch ứng làm sao là bội phản ứng thoái hóa – khử?
* giải thuật bài 9 trang 87 SGK Hóa 10:
a) (1) 2KClO3 2KCl + O2↑
(2) S + O2 SO2
(3) SO2 + NaOH → Na2SO3 + H2O
⇒ làm phản ứng oxi hóa – khử là (1) với (2).
Xem thêm: Các Bài Thơ Trung Đại Việt Nam, Các Tác Phẩm Văn Học Trung Đại Lớp 7
b) (1) S + H2 H2S
(2) 2H2S + 3O2 → 2SO2 + 2H2O
(3) 2SO2 + O2
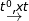
(4) SO3 + H2O → H2SO4
⇒ Phản ứng lão hóa – khử là: (1), (2), (3)
Hy vọng với nội dung bài viết về phân loại phản ứng trong hoá học tập vô cơ và bài xích tập vận dụng ngơi nghỉ trên hữu ích cho các em. Mọi thắc mắc và góp ý những em phấn kích để lại bình luận dưới nội dung bài viết để fashionssories.com nghi nhận với hỗ trợ, chúc các em học tập tốt.